 学术前沿
学术前沿
 学术前沿
学术前沿

齐鲁医院心血管实验室2023年首批研究新进展
时间:2023-04-04 12:37:15 浏览量: 次
【本站讯】近日,教育部和国家卫健委心血管重构与功能研究重点实验室张澄、张文程和张猛教授团队在心血管病基础研究领域取得了系列新进展,研究成果先后发表于Nature子刊Nature Communications(中科院一区,最新影响因子17.694)、Nature旗下期刊Cell Death & Differentiation (中科院一区,最新影响因子12.067)以及美国心脏协会权威会刊Arteriosclerosis Thrombosis and Vascular Biology (中科院一区,最新影响因子10.514),受到国际学术界的高度关注。

胚胎发育、组织损伤修复、肿瘤发生发展等一系列病理生理活动均伴随着血管新生,所谓“兵马未动,粮草先行”,血管新生关乎各类生命活动。血管新生异常可导致多种疾病如心肌缺血、视网膜病变、肿瘤、间歇性跛行等,探索血管正常和异常新生的机制对于人类疾病的防治具有普遍意义。血管紧张素转换酶抑制剂(ACEI)已广泛用于心血管疾病尤其是高血压和心力衰竭的治疗,其治疗机制是抑制了血管紧张素II的生成。近年研究发现,ACEI可能影响了体内的血管新生,但其调控机制尚不清楚。张文程教授课题组在下肢缺血患者的腓肠肌标本中发现血管内皮的Sp1/Sp3含量显著降低,由此构建了血管内皮细胞Sp1/Sp3特异性基因双敲小鼠模型。结果发现,内皮Sp1/Sp3敲除可导致P5乳鼠的视网膜血管新生速度减慢、成年小鼠后肢缺血后血流速度恢复减缓、伤口愈合延缓、小鼠皮下种植瘤生长速度减慢以及肿瘤内血管密度显著降低。当给予小鼠ACEI治疗后,发现在除皮下种植瘤以外的其他上述体内模型中血管新生速度明显加快,但在Sp1/Sp3敲除小鼠中ACEI促血管新生的作用几乎消失,证明在内皮细胞中Sp1/Sp3可能是ACEI调控血管新生的重要蛋白。课题组利用小干扰RNA文库筛选了参与ACEI上调内皮细胞Sp1/Sp3的去泛素化蛋白,发现抑制USP7可显著减弱ACEI在视网膜、后肢缺血、体内基质胶等多种血管新生模型中的作用。深入分子机制研究表明,USP7通过1-208段氨基酸序列与Sp1/Sp3相结合,促进K48位去泛素化修饰,进而稳定Sp1/Sp3蛋白的含量。同时,Sp1/Sp3的乙酰化水平和去乙酰化酶HDAC1可调控USP7的作用,ACEI可通过CK2促进USP7从胞质向胞核的转移。在视网膜原代内皮细胞中,Sp1/Sp3敲除可显著抑制NOTCH通路,在视网膜和后肢缺血模型中NOTCH抑制剂DAPT可恢复Sp1/Sp3敲除小鼠受损的血管新生能力。体外实验发现,Sp1/Sp3可结合NOTCH1基因启动子区域,Sp3和Sp1可协同抑制NOTCH1基因的转录而调控血管新生。该研究首次发现了内皮细胞中Sp1/Sp3是ACEI促进血管新生的关键下游蛋白,ACEI通过激活USP7入核而上调Sp1/Sp3的蛋白表达,Sp3和Sp1可协同抑制NOTCH1-VEGFR2通路,从而证明了USP7- Sp1/Sp3-NOTCH1-VEGFR2通路在血管新生和ACEI药理新机制中的重要作用,为血管新生相关疾病提供了治疗靶点。该研究发表于Nature子刊Nature Communications,山东大学齐鲁医院心内科博士生吕翰林为本文的第一作者,山东大学齐鲁医院张文程教授为本文的通讯作者,山东大学齐鲁医院为第一和通讯作者单位。
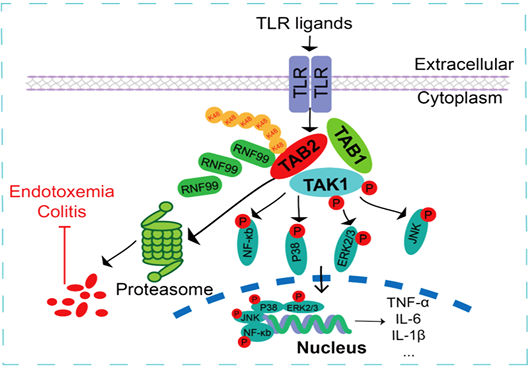
天然免疫是机体抵抗病原微生物感染的第一道防线。巨噬细胞TLR受体感知病原微生物后,节点蛋白TAB2与蛋白激酶TAK1形成复合物,激活TAK1的激酶活性,通过下游MAPK-NF-KB通路诱导炎症因子的产生。过度的炎症反应可诱发脓毒血症和炎症风暴,进而导致多脏器衰竭,严重危害人类健康。在新冠疫情期间,炎症风暴是轻症发展为重症和危重症的关键发病机制,也是重症和危重症患者死亡的主要原因。探讨TAK1-TAB2复合物清除及天然免疫炎症反应的负向调控机制,将为脓毒血症所致心肾损伤提供干预靶点,具有重要的科学意义和临床价值。张澄教授和张猛教授团队收集了脓毒血症患者和健康人的外周血单核细胞,发现E3泛素连接酶RNF99的表达水平在脓毒血症患者外周血单核细胞中显著降低,提示RNF99可能是天然免疫炎症反应的反馈调节因子。课题组利用蛋白质质谱、泛素化修饰等实验方法,发现E3泛素连接酶RNF99可与TAB2发生结合,催化其第611位赖氨酸发生K48位泛素化修饰,促进TAB2经蛋白酶体途径的降解,抑制TAK1的复合物形成和激酶活化,最终负向调控巨噬细胞炎症反应。课题组构建了E3泛素连接酶RNF99的基因敲除小鼠,发现RNF99基因敲除促进了巨噬细胞炎症反应并增加了小鼠的死亡率。在RNF99基因缺失的小鼠中回补野生型小鼠的骨髓细胞后,血液中炎症因子水平显著下降,炎症风暴和脏器损伤减轻,小鼠死亡率降低。该研究首次证明了E3泛素连接酶RNF99可负向调控巨噬细胞的炎症免疫反应,进而减轻了小鼠的内毒素血症和脏器损伤,同时鉴定出可调控TAB2降解的关键赖氨酸位点,阐明了天然免疫炎症过度活化的关键调控机制。该研究发表于Nature旗下期刊Cell Death & Differentiation,山东大学齐鲁医院心内科博士后张杰和博士生曹磊为本文的共同第一作者,山东大学齐鲁医院张澄教授和张猛教授为本文的共同通讯作者,山东大学齐鲁医院为本文的第一和通讯作者单位。

动脉粥样硬化(AS)是一种多种细胞参与的慢性炎症性疾病,其中巨噬细胞在AS进展中起着重要作用。MAPK信号通路的活化可导致巨噬细胞释放大量的炎症因子,促进AS斑块的形成。近年来,临床试验已证实抗炎治疗可显著降低AS患者心血管事件的发生率。因此,探索MAPK信号通路新的调控机制具有重要的科学意义和临床价值。张澄教授和张猛教授团队分析了AS斑块组织的单细胞数据库,发现AS斑块中m6A甲基转移酶METTL3 阳性的巨噬细胞数量明显增加。病理学研究显示,小鼠AS斑块内巨噬细胞METTL3的表达随病变进展逐渐增强,并伴有炎症因子生成和巨噬细胞浸润增加。体外研究发现,氧化低密度脂蛋白刺激可显著增加巨噬细胞METTL3的表达。课题组构建了具有ApoE-/-背景的巨噬细胞特异性METTL3基因敲除小鼠,发现巨噬细胞METTL3缺失显著抑制了巨噬细胞浸润、炎症反应和AS进展。深入机制研究发现,METTL3催化BrafmRNA上特定的腺苷(39725126)发生m6A修饰并提高其翻译效率,进而增加了MEK1/2和ERK的磷酸化水平,最终导致炎症因子的过度产生。课题组同时探讨了YTHDF1、YTHDF2、YTHDF3三种阅读蛋白对BRAF蛋白表达的影响,发现YTHDF1可与Braf mRNA结合,敲低YTHDF1基因可降低BRAF蛋白的表达。上述结果提示,在高血脂症的背景下,AS斑块内巨噬细胞METTL3的表达上调及其诱发的巨噬细胞炎症反应,可能是AS发生发展的重要机制。该研究首次利用巨噬细胞条件性METTL3基因敲除小鼠,明确了巨噬细胞m6A甲基化修饰在AS炎症反应中的关键作用,鉴定出了METTL3的新型作用靶点,为今后应用METTL3小分子抑制剂治疗AS提供了重要的理论依据。该研究发表于美国心脏协会权威会刊Arteriosclerosis Thrombosis and Vascular Biology,山东大学齐鲁医院心内科博士生李倩为本文的第一作者,山东大学齐鲁医院张澄教授和张猛教授为本文的共同通讯作者,山东大学齐鲁医院为本文的第一和通讯作者单位。
相关链接:
https://pubmed.ncbi.nlm.nih.gov/36759621/
https://pubmed.ncbi.nlm.nih.gov/36681779/
https://pubmed.ncbi.nlm.nih.gov/36951060/
【作者:隋文海 来源:心血管实验室 责编:李小诗 审核:刘艳】
| 单位 | 发布量 | |
| 1 | 学生工作处 | 12 |
| 2 | 党委宣传统战部 | 10 |
| 3 | 教育处 | 7 |
| 4 | 门诊部 | 7 |
| 5 | 普通外科 | 7 |
| 6 | 团委 | 5 |
| 7 | 人事处 | 5 |
| 8 | 医务处 | 5 |
| 9 | 医师培训处 | 5 |
| 10 | 后勤保障处 | 5 |
| 11 | 心血管内科 | 5 |
| 12 | 骨科 | 4 |
| 13 | 神经内科 | 4 |
| 14 | 急诊科 | 4 |
| 15 | 手术室 | 4 |